The Next Generation
Genome Editing Technology
RIDE of GERNA Biotech
4th tech.
No Cas system
More Safety
Lower error rate, off-target
wide coverage
No PAM sequence dependency
Achieve Your Goals
with Strategy
GERNA Biotech是利用自主研发新一代基因编辑技术研究和开发基因治疗剂的企业。
What we do
基因编辑技术的发展可以分为三代,即第一代ZFN技术、第二代TALEN技术和第三代CRISPR-Cas9技术。
CRISPR-Cas9作为能自源头解决遗传疾病问题的技术而备受期待。
但由于CRISPR-Cas9的double strand break以及修复过程中会产生副作用(DSB issue),治疗剂的研发也面临短序列guide-RNA导致的off-target issue与PAM sequence依赖性造成的应用范围局限等巨大障碍。
虽然许多研究都在试图提高Cas的功能,也出现了类似prime-editing的先进技术,但DNA break和修复过程中产生的副作用以及短序列guide-RNA导致的off-target issue和PAM sequence依赖性局限依然存在。


1st POC of RIDE
The simple POC in human cells
GERNA Biotech自主研发的基因编辑技术没有使用Cas技术,从这一点上讲,该技术可视为第4代基因编辑技术。
该技术采用完美设计的RNA,是利用细胞内DNA修复机制的新方法。
作为Non-Cas技术,不含DNA break和修复过程避免了DSB issue问题,由于使用了比以往更长的guide-RNA,off-target issue较少发生。又因为这项技术不依赖PAM sequence,可以解决75%的突变遗传疾病。
GERNA Biotech的RNA-instructed DNA editing technology(简称RIDE technology)是全新的第4代基因编辑技术。

2nd Approach We Follow
Project Workflow
GERNA Biotech通过简单的实验验证了RIDE技术。
1.Single nucleotide polymorphism mending
– 有意将添加了SNP的GFP gene cloning到vector。
– 将GFP出现问题的vector注射到人类细胞株(HEK293T)中。
– 该细胞的GFP出现问题,因此不会发出荧光。
– 在该细胞中注射体现完美设计RIDE的vector,以修复GFP的mutation。
– 细胞中出现RIDE,通过细胞内的修复机制修复GFP的SNP。
– GFP恢复正常的细胞中出现了GFP,并观测到了荧光。
2.Multiple mutation mending
– 有意将添加了多种类型的两个SNP的GFP gene cloning到vector。
– 将GFP出现问题的vector注射到人类细胞株(HEK293T)中。
– 该细胞的GFP出现问题,因此不会发出荧光。
– 在该细胞中注射可体现完美设计RIDE的vector,以修复GFP的multiple mutation。
– 细胞中出现RIDE,通过细胞内的修复机制修复GFP的multiple mutation。
– GFP恢复正常的细胞中出现了GFP,并观测到了荧光。
3.Deletion mending
– 有意将发生多种类型deletion的GFP gene cloning到vector。
– 将GFP出现问题的vector注射到人类细胞株(HEK293T)中。
– 该细胞的GFP出现问题,因此不会发出荧光。
– 在该细胞中注射体现完美设计RIDE的vector,以修复GFP。
– 细胞中出现RIDE,通过细胞内的修复机制修复GFP的deletion。
– GFP恢复正常的细胞中出现了GFP,并观测到了荧光。

3rd Approach We Follow
POC in human genome
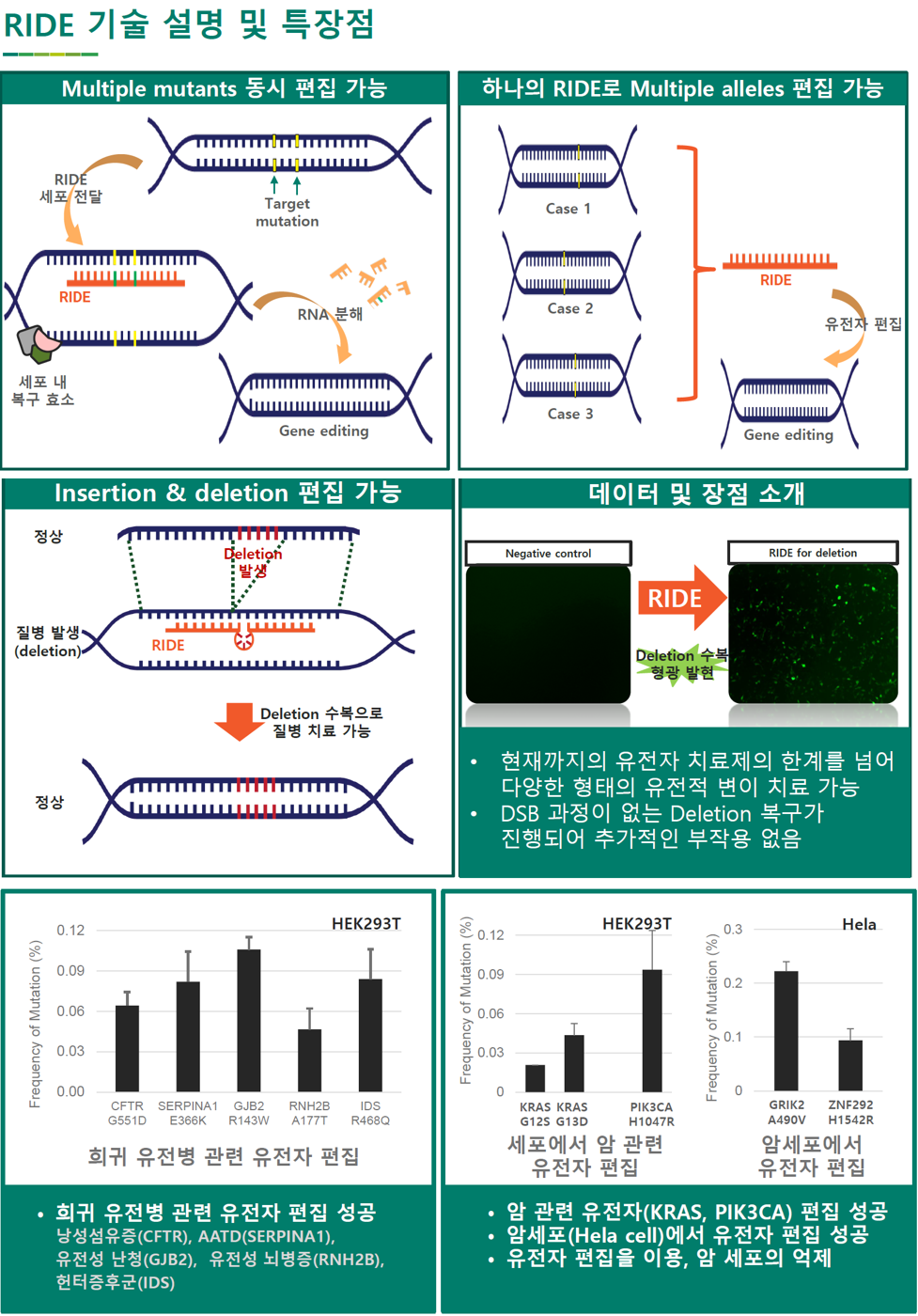
GERNA Biotech利用RIDE在人类细胞株和癌细胞中直接编辑genome。
1.制造有关遗传性稀有疾病的基因突变
– 在人类细胞株(HEK293T)中,寻找已知导致稀有遗传疾病的基因。
– 我们把囊肿性纤维化(CFTR_G551D)、AATD (SERPINA1_E366K)、遗传性耳聋(GJB2_R143W)、遗传性脑病(RNH2B_A177T)、亨特氏综合征(IDS_R468Q)相关的遗传突变作为对象。
– 在各基因已知突变位置设计导致突变的RIDE。
– 将完美设计的RIDE以oligo-nucleotide形态注射到细胞内。
– ddPCR结果显示在该基因内发生了突变。
2.编辑癌症有关基因
– 在人类细胞株(HEK293T)中,选择已知有关癌症的基因
– 在该基因已知突变位置设计导致突变的RIDE: p53(, KRAS(G12S, G13D), PIK3CA(H1047R)
– 将完美设计的RIDE以oligo-nucleotide形态注射到细胞内
– ddPCR结果显示在该基因内发生了突变
3.编辑癌细胞基因
– 在癌细胞株(Hela)中,选择已知有关癌症的基因
– 在该基因已知突变位置设计导致突变的RIDE: GRIK2_A490V, ZNF292_H1542R
– 将完美设计的RIDE以oligo-nucleotide形态注射到细胞内
– ddPCR结果显示在该基因内发生了突变

4th Approach We Follow
Project Workflow
GERNA Biotech正在通过RIDE技术研发基因治疗剂。
以下管道是现在正在进行的in vivo实验。
1.从抑癌基因p53中剔除突变的基因治疗剂
抑癌基因p53中的突变会因衰老和压力而逐渐增多。
其中,发生致命性变异时就会发生癌症。
在大部分患者中发现随机发生了多种基因变异。
在CRISPR-Cas中,需要针对每次的突变研发治疗剂,而RIDE只需要知道恢复的sequence就能立即治疗。
2.长寿基因SIRT6
在超过100岁长寿人群中均发现了相同的SIRT6突变。
改变普通人的SIRT6基因有助于人类整体健康。
该部位约为35mer,使用目前的CRISPR-Cas9很难编辑。
理论上而言用CRISPR-Cas system摘除整个部位后植入DNA-fragment确实可行,但在修复DSB的过程中产生突变的可能性过高,无法预测在诸如TASL起到多重作用的基因上产生的副作用,因此,当前还很难使用CRISPR-Cas system。
RIDE技术作为不含DNA break过程而可以同时编辑多个突变的技术,能够开发该基因治疗剂。
3.肥胖基因TASL
众所周知,因deletion导致的TASL故障可能会引发肥胖。
理论上而言用CRISPR-Cas system切断产生deletion的DNA后植入DNA-fragment确实可行,但在修复DSB的过程中产生突变的可能性过高,无法预测在诸如TASL起到多种作用的基因上的副作用,因此,当前还很难使用CRISPR-Cas system。
RIDE作为不含DNA break过程而可以修复deletion的技术,能够开发该基因治疗剂。
GERNA Biotech通过自主研发新一代基因编辑技术RIDE修复(mending)DNA的mutation这一疾病根源,致力于为人类提供健康舒适的生活。

Achieve Your Goals
with Strategy
The goal and strategy of GERNA Biotech





