The Next Generation
Genome Editing Technology
RIDE of GERNA Biotech
4th tech.
No Cas system
More Safety
Lower error rate, off-target
wide coverage
No PAM sequence dependency
Achieve Your Goals
with Strategy
株式会社GERNA BIOTECHは、自社開発の次世代ゲノム編集技術を利用した遺伝子治療薬の研究・開発を行っている。
What we do
ゲノム編集技術は、第一世代のZFN、第二世代のTALEN、第三世代のCRISPR-Cas9の順に発達してきた。
中でも、CRISPR-Cas9は遺伝子疾患の根本的な治療法として大いに注目された。
しかし、CRISPR-Cas9におけるDSB(double strand break)およびその修復過程での副作用(DSB issue)、guide-RNAが短いことによるoff-target、PAMによる標的配列制限などが、治療薬の開発において障壁となっている。
Casの機能を向上させるための数々の研究が行われ、prime-editingなどの優れた技術が登場したりもしたが、問題は依然として残ったままである。


1st POC of RIDE
The simple POC in human cells
株式会社GERNA BIOTECHが自社開発したゲノム編集技術はCasを使用しない手法であり、第四世代の技術とも言える。
この技術は、高度に設計されたRNAと細胞内のDNA修復メカニズムを利用した新しい方法だ。
Non-Cas技術であり、DNA breakや修復過程がないことから、これらに起因する問題も発生せず、長いguide-RNAを使用するためoff-targetの発生も少ない。 また、PAMによる標的配列制限もないため、数字の上では遺伝子疾患の原因となる突然変異全体の75%に対応できる。
株式会社GERNA BIOTECHは、この次世代ゲノム編集技術をRNA-instructed DNA editing technology、略してRIDE technologyと名付けた。

2nd Approach We Follow
Project Workflow
株式会社GERNA BIOTECHは、簡単な実験によってRIDE技術を証明した。
1. Single nucleotide polymorphism mending
-人為的にSNPを導入したGFP geneをvectorにcloningする。
-このvectorをヒト細胞株(HEK293T)に注入する。
-この細胞はGFPが機能しないため蛍光を示さない。
-この細胞に、GFPのmutationを修復できる高度に設計されたRIDEを発現するvectorを注入する。
-細胞内にRIDEが発現し、細胞内の修復メカニズムを通じてGFPのSNPが修復される。
-GFPの機能が正常化し、細胞は蛍光を示した。
2. Multiple mutation mending
-人為的に複数のSNPを導入したGFP geneをvectorにcloningする。
-このvectorをヒト細胞株(HEK293T)に注入する。
-この細胞はGFPが機能しないため蛍光を示さない。
-この細胞にGFPのmultiple mutationを修復できる高度に設計されたRIDEを発現するvectorを注入する。
-細胞内でRIDEが発現し、細胞内の修復メカニズムを通じてGFPのmultiple mutationが修復された。
-GFPの機能が正常化し、細胞は蛍光を示した。
3. Deletion mending
-人為的に複数のdeletionを発生させたGFP geneをvectorにcloningする。
-このvectorをヒト細胞株(HEK293T)に注入する。
-この細胞はGFPが機能しないため蛍光を示さない。
-この細胞に、GFPを修復できる高度に設計されたRIDEを発現するvectorを注入する。
-細胞内でRIDEが発現し、細胞内の修復メカニズムを通じてGFPのdeletionが修復された。
-GFPの機能が正常化し、細胞は蛍光を示した。

3rd Approach We Follow
POC in human genome
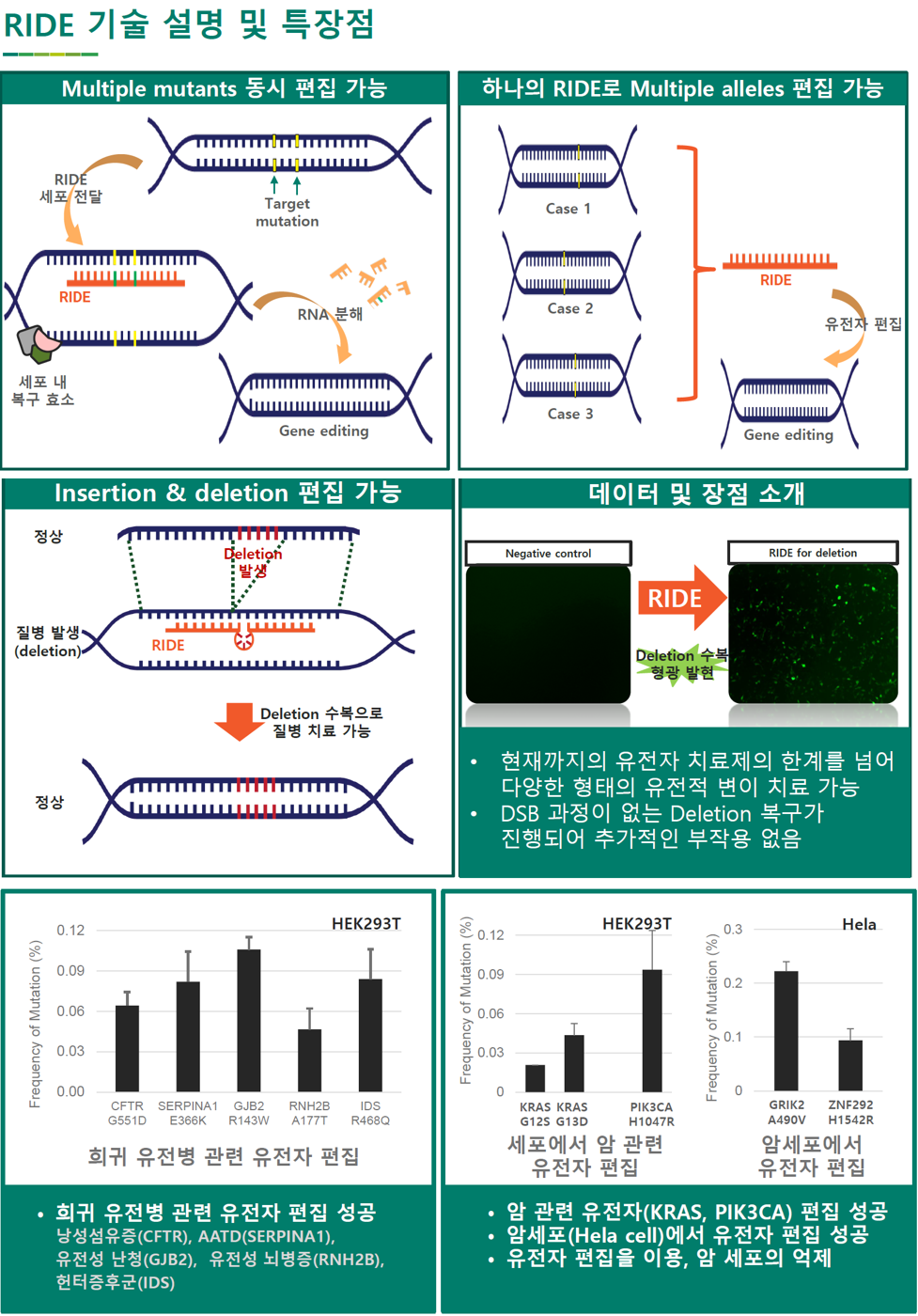
株式会社GERNA BIOTECHは、ヒト由来細胞株やがん細胞でRIDEを利用したヒトゲノム編集を行った。
1. 遺伝性希少疾患に関連する遺伝子の突然変異体の作製
-ヒト由来細胞株(HEK293T)でよく知られている遺伝性希少疾患を引き起こす遺伝子を選択する。
-我々は嚢胞性線維症(CFTR_G551D)、AATD(SERPINA1_E366K)、遺伝性難聴(GJB2_R143W)、遺伝性白質疾患(RNH2B_A177T)、ハンター症候群(IDS_R468Q)の既知の突然変異をターゲットにした。
-各遺伝子に突然変異を引き起こすRIDEを設計する。
-高度に設計されたRIDEをoligo-nucleotideの形で細胞内に注入する。
-ddPCRにより、この遺伝子に突然変異が起きたことが確認された。
2. がん関連のゲノム編集
-ヒト由来細胞株(HEK293T)でよく知られているがん関連遺伝子を選択する。
-その遺伝子に突然変異を引き起こすRIDEを設計する:p53(, KRAS(G12S, G13D), PIK3CA(H1047R)
-高度に設計されたRIDEをoligo-nucleotideの形で細胞内に注入する。
-ddPCRにより、この遺伝子に突然変異が起きたことが確認された。
3. がん細胞でのゲノム編集
-がん細胞株(Hela)でよく知られているがん関連遺伝子を選択する。
-この遺伝子に突然変異を引き起こすRIDEを設計する:GRIK2_A490V、ZNF292_H1542R
-高度に設計されたRIDEをoligo-nucleotideの形で細胞内に注入する。
-ddPCRにより、この遺伝子に突然変異が起きたことが確認された。

4th Approach We Follow
Project Workflow
株式会社GERNA BIOTECHはRIDE技術を利用した遺伝子治療薬の研究・開発を行っている。
現在、下記のパイプラインについてin vivo試験を進行中である。
1. がん抑制遺伝子p53の突然変異を修復する遺伝子治療薬
老化やストレスにより、がん抑制遺伝子p53に突然変異がみられるようになる。
その中で致命的な突然変異が生じると、がんが発生する。
多くのがん患者において、多数の遺伝子変異がランダムに発生していることが確認された。
CRISPR-Casでは各突然変異に対する治療薬を開発しなければならないが、RIDEではターゲットとなるsequenceさえわかれば即治療が可能である。
2. 長寿遺伝子SIRT6
100歳以上の長寿の人には、共通してSIRT6の突然変異がみられる。
よって、SIRT6は全人類が健康な生活を享受するために極めて重要であると思われる。
SIRT6は35merほどで、現在のCRISPR-Cas9技術ではゲノム編集が困難である。
CRISPR-Cas systemで該当部位を切断したのちDNA-fragmentを挿入する方法も理論的には可能だが、DSB修復過程で突然変異が発生する可能性が非常に高く、またTASLなどの様々な役割を持つ遺伝子での副作用を予測することは困難であるため、CRISPR-Cas systemを利用することは難しい。
一方、RIDEはDNA break過程がなく、また同時に多数の遺伝子を改変できるため、SIRT6遺伝子治療薬の開発に有効である。
3. 肥満遺伝子TASL
DeletionによりTASLに異常が生じると肥満が起こることがわかっている。
CRISPR-Cas systemでdeletionが起きた部分のDNAを切断したのちDNA-fragmentを挿入する方法も理論的には可能だが、DSB修復過程で突然変異が起きる可能性が非常に高く、またTASLのように様々な役割を持つ遺伝子での副作用を予測することは困難であるため、CRISPR-Cas systemを利用することは難しい。
一方、RIDEはDNA break過程がなく、deletionも修復できるため、TASL遺伝子治療薬の開発に有効である。
株式会社GERNA BIOTECHは、疾病の原因となるDNAのmutationを修復(mending)する次世代ゲノム編集技術RIDEを通じて人類の幸福に貢献することを目指している。

Achieve Your Goals
with Strategy
The goal and strategy of GERNA Biotech





